ออกซิเจน
ออกซิเจน
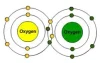
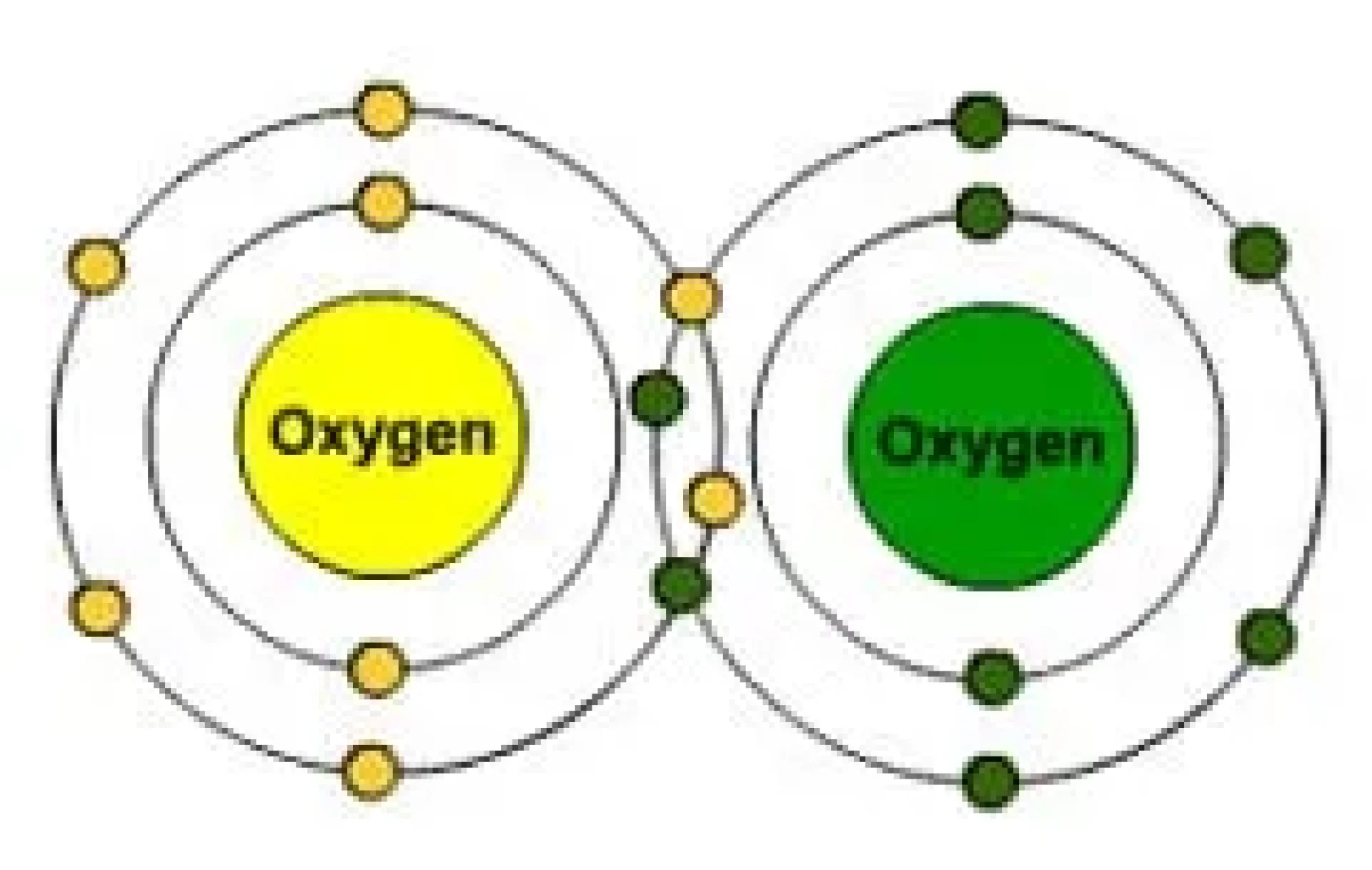
ออกซิเจน เป็นองค์ประกอบทางเคมีที่มี O เป็นสัญลักษณ์ และมีเลขอะตอม คือ 8 อยู่ในกลุ่ม chalcogen ในตารางธาตุและเป็นองค์ประกอบที่ไม่ใช่โลหะ และมีความไม่สเถียรนจึงเกิดปฏิกิริยาออกซิเดชั่นกับธาตุอื่นๆ ได้ง่าย ออกซิเจนมีอยู่ทั่วไปในโลก และจักรวาลอยุ่ในรูปของอะตอมออกซิเจน 2 อะตอม เรียกว่า dioxygen เป็นก๊าซที่ไม่มีสี ไม่มีกลิ่น และไม่มีรสชาติ
 โมเลกุลหลายชนิดที่อยู่ในกลไกของสิ่งมีชีวิต เช่น โปรตีน กรดนิวคลีอิก คาร์โบไฮเดรต และไขมัน ประกอบด้วยออกซิเจน ส่วนองค์ประกอบที่เป็นอนินทรีย์ เช่น เปลือก ฟัน และกระดูก มีออกซิเจนที่อยู่ในรูปของน้ำเป็นส่วนส่วนประกอบ มวลของสิ่งมีชีวิต 2 ใน 3 ส่วน ของมวลร่างกายมีน้ำเป็นองค์ประกอบ ออกซิเจนถูกสังเคราะห์จากไซยาโนแบคทีเรียน สาหร่าย และพืช จากกระบวนการหายใจที่ซับซ้อน
โมเลกุลหลายชนิดที่อยู่ในกลไกของสิ่งมีชีวิต เช่น โปรตีน กรดนิวคลีอิก คาร์โบไฮเดรต และไขมัน ประกอบด้วยออกซิเจน ส่วนองค์ประกอบที่เป็นอนินทรีย์ เช่น เปลือก ฟัน และกระดูก มีออกซิเจนที่อยู่ในรูปของน้ำเป็นส่วนส่วนประกอบ มวลของสิ่งมีชีวิต 2 ใน 3 ส่วน ของมวลร่างกายมีน้ำเป็นองค์ประกอบ ออกซิเจนถูกสังเคราะห์จากไซยาโนแบคทีเรียน สาหร่าย และพืช จากกระบวนการหายใจที่ซับซ้อน
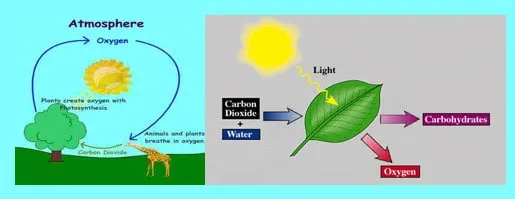
ธาตุออกซิเจนเริ่มสะสมในชั้นบรรยากาศประมาณ 2.5 พันล้านปีที่ผ่านมา ประมาณพันล้านปีหลังจากพบในสิ่งมีชีวิต ก๊าซออกซิเจน O2 พบในอากาศถึง 20.8% ออกซิเจนเป็นธาตุที่อุดมสมบูรณ์มากในปลือกโลก พบอยู่ในรูปของซิลิกอนไดออกไซด์ซึ่งเป็นองค์ประกอบเกือบครึ่งของมวลเปลือกโลก นอกจากนี้ออกซิเจนเป็นส่วนสำคัญของบรรยากาศ และเป็นสิ่งจำเป็นในการดำรงชีวิตของสิ่งมีชีวิตมากที่สุด ถูกใช้ในกระบวนการหายใจ ปฎิกิริยาทางเคมี การสังเคราะห์แสงของสิ่งมีชีวิต ซึ่งใช้พลังงานจากแสงอาทิตย์ในการผลิตออกซิเจน น้ำ ในอีกรูปแบบหนึ่ง อะตอมของออกซิเจนที่อยู่ในรูปของโอโซนช่วยดูดซับรังสียูวีบี และรังสีอังตราไวโอเลต
ออกซิเจนและน้ำ : กลไกปฏิกิริยา ผลกระทบต่อสิ่งแวดล้อมและผลกระทบต่อสุขภาพ
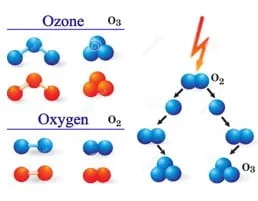
ออกซิเจนเป็นธาตุที่มีมากที่สุดในโลก ออกซิเจนอยู่เป็น O2 และ O3 (โอโซน) และสามารถพบได้ละลายในน้ำเป็นโมเลกุล O2 ดังนั้นปริมาณออกซิเจนของน้ำทะเลเป็น 85.7% ก๊าซออกซิเจนไม่ทำปฏิกิริยากับน้ำ และสามารถละลายน้ำได้ ดังสมการนี้
O2 + 2 H2O + 4 e- -> 4 OH-
ออกซิเจนอาจจะออกซิไดซ์สารอินทรีย์ซึ่งเป็นหลักในกระบวนการทางชีวภาพ กลไกการเกิดปฏิกิริยาที่สามารถอธิบายด้วยวิธีการของความสมดุลของอิเล็กตรอน ดังตัวอย่างด้านล่าง (H2O ได้รับการยกเว้น):
Fe2+ + 0,25 O2 -> Fe(OH)3 + 2,5 H+
Mn2+ + O2 -> MnO2 + 2 H+
NH4+ + 2 O2 -> NO3 + 6 H+
CH4 + 2 O2 -> CO2 + 4 H+
ออกซิเจนละลายน้ำตามธรรมชาติเมื่อสัมผัสกับอากาศ ออกซิเจนจะถูกนำไปใช้ในเชิงพาณิชย์ เพื่อวัตถุประสงค์ในการอุตสาหกรรมองค์ประกอบที่สกัดจากอากาศโดยประมาณ 100 ล้านตันต่อปี ของจำนวน 55% จะถูกนำไปใช้ในการผลิตเหล็ก 25% จะถูกนำไปใช้ในอุตสาหกรรมเคมีและส่วนที่เหลือถูกนำไปใช้ในโรงพยาบาลสำหรับการเริ่มต้นขีปนาวุธและสำหรับตัดโลหะ ในอุตสาหกรรมเคมีปฏิกิริยาของออกซิเจนและเอทิลีถูกมาใช้และเอทิลีนออกไซด์ที่เกิดขึ้นจะถูกนำไปใช้เป็นสารป้องกันการแข็งตัวและเส้นใยสังเคราะห์ ถูกนำไปใช้เป็นสารฟอกขาว ออกซิเจนในสารโอโซนถูกนำมาใช้ในการฆ่าเชื้อในน้ำดื่ม น้ำไม่ได้รับการปนเปื้อนด้วยออกซิเจนเมื่อมันถูกนำมาใช้อุตสาหกรรม
ความเข้มข้นของออกซิเจนทั้งหมดในร่างกายมนุษย์มีประมาณ 60% ของน้ำหนักตัวทั้งหมด ค่านี้ อาจแตกต่างกัน เพราะส่วนใหญ่มีอยู่ในโมเลกุลของน้ำ มนุษย์ดูดซับออกซิเจนผ่านปอด ซึ่งกว่าจะโอนถ่ายไปยังอวัยวะต่างๆ ผ่านเลือด จะถูกส่งโดยเส้นเลือดฝอย และกลุ่มการทำงานอื่น ๆ ที่ส่งผ่านเลือดจะเกี่ยวข้องกับฮีโมโกล และต่อมาจะถูกเก็บไว้ในกล้ามเนื้อในรูปของ myoglobin ออกซิเจนในน้ำดื่มเป็นสิ่งที่ดีที่จะช่วยให้การสร้าเกราะป้องกันโรค เช่น โรคมะเร็ง โรคหัวใจและหลอดเลือด
นอกจากนี้เมื่ออากาศมีความเข้มข้นของออกซิเจนต่ำกว่า 3% ทำให้หายใจไม่ออกและเสียชีวิตในที่สุด ที่ระดับความเข้มข้นต่ำกว่า 7% อาจทำให้หมดสติ แต่ถ้าออกซิเจนมากเกินไปอาจทำให้เสียชีวิตได้ เช่น นักดำน้ำ ที่ใช้ลมหายใจจากออกซิเจนบริสุทธิ์ มักจะเกิดตะคริว และทารกที่ได้รับออกซิเจนมากเกินไปในตู้อบ โดยทั่วไปอาจจะทำให้ตาบอด
นอกจากนี้โอโซน ซึ่งเป็นรูปหนึ่งของออกซิเจน สามารถนำไปใช้ในการทำน้ำให้บริสุทธิ์ เช่น สระว่ายน้ำหรือฆ่าเชื้อในน้ำดื่ม แต่การป้องกันจากเชื้อแบคทีเรียเพียงสั้น ๆ โอโซนเป็นรูปแบบที่ไม่มั่นคงของออกซิเจนและดังนั้นจึงจะถูกแปลงได้อย่างรวดเร็วกลับไปที่ O2 อีกด้วย